下列物质属于电解质的是()
A.石墨 B.NaOH溶液 C.乙醇 D.Na2CO3
知识点:物质的分类
D
考点:电解质与非电解质.
专题:电离平衡与溶液的pH专题.
分析:电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质在水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;非电解质是指:在熔融状态和水溶液中都不能导电的化合物;单质,混合物既不是电解质也不是非电解质;据此即可解答.
解答:解:A、石墨是非金属单质,它既不是电解质也不是非电解质,故A错误;
B、NaOH溶液中有自由移动的钠离子和氢氧根离子,能导电,但它是混合物,电解质必须是化合物,所以它既不是电解质也不是非电解质,故B错误;
C、乙醇不能电离出自由移动的离子,属于化合物,是非电解质,故C错误;
D、碳酸钠由钠离子和碳酸根离子构成,固体没有自由移动的离子,所以不导电;在水溶液中或熔融状态下,能电离出自由移动的钠离子和碳酸根离子导电,是电解质,故D正确;
故选D.
点评:本题重点考查了电解质、非电解质概念的辨析,解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件,题目难度不大.
下列物质的分类合理的是()
A.氧化物:CO2、NO、SO2、H2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O
D.碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
知识点:物质的分类
A
考点:酸、碱、盐、氧化物的概念及其相互联系.
专题:物质的分类专题.
分析:A.氧化物是指只含有两种元素,且其中一种元素是氧元素的化合物;
B.电离产生的阴离子全部是氢氧根离子的化合物属于碱;
C.含有铵根离子的盐为铵盐;
D.碱性氧化物是指能跟酸起反应,只生成盐和水的氧化物.
解答:解:A.CO2、NO、SO2、H2O中各种物质都只含两种元素,且其中一种元素是氧元素的化合物,都是氧化物,故A正确;
B.碳酸钠电离产生钠离子与碳酸根离子,属于盐,故B错误;
C.NH3•H2O属于碱,故C错误;
D.Mn2O7属于酸性氧化物,Al2O3属于两性氧化物,故D错误;
故选:A.
点评:本题侧重考查基本概念,题目难度不大,熟悉各物质的性质和组成是解题关键.
氧化还原反应的实质是()
A.得氧和失氧 B.化合价的升降
C.有无新物质生成 D.电子的转移
知识点:氧化还原反应
D
考点:氧化还原反应.
分析:氧化还原反应的特征为化合价的升降,其实质为电子的转移,以此来解答.
解答:解:A.部分氧化还原反应中存在得氧和失氧,但是有的氧化还原反应中没有得氧和失氧,如氯气与氢气的反应,故A不选;
B.元素化合价变化为氧化还原反应的特征,故B不选;
C.有无新物质生成不能确定是否有电子转移,不一定是氧化还原反应,故C不选;
D.电子的转移为氧化还原反应的实质,故D选;
故选D.
点评:本题考查氧化还原反应的实质,明确实质为电子的转移,特征为化合价的升降即可解答,题目较简单.
选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是()
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且密度必须比水大
D.不溶于水,且密度必须比水小
知识点:仪器和基本操作
B
考点:分液和萃取.
专题:化学实验基本操作.
分析:萃取剂必须具备下列条件:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应.
解答:解:萃取是利用溶质在互不相溶的溶剂里的溶解度的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来.根据萃取的定义知:萃取剂必须具备下列条件:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应.
A.选取的萃取剂与原溶剂必须互不相溶,且萃取剂和碘不发生反应,故A错误;
B.选取的萃取剂与原溶剂必须互不相溶,且溶质在萃取剂中的溶解度大于在水中的溶解度,故B正确.
C.萃取剂必须和水不互溶,但密度不一定比水的大,故C错误.
D.萃取剂必须和水不互溶,但密度不一定比水的小,故D错误.
故选B.
点评:本题考查了萃取剂的选择原则,其原则是:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应.萃取是物质分离、提纯的常用物理方法,难度不大.
以下电离方程式错误的是()
A.MgCl2═Mg2++2Cl﹣ B.Fe2(SO4)3═2Fe3++3SO42﹣
C.NaClO═Na++Cl﹣+O2﹣ D.KAl(SO4)2═K++Al3++2SO42﹣
知识点:离子方程式
C
考点:电离方程式的书写.
专题:电离平衡与溶液的pH专题.
分析:A、氯化镁是强电解质,水溶液中完全电离生成镁离子和氯离子;
B、Fe2(SO4)3是强电解质,水溶液中完全电离生成铁离子和硫酸根离子;
C、NaClO是强电解质水溶液中完全电离生成钠离子和次氯酸根离子;
D、KAl(SO4)2属于强电解质,水溶液中完全电离.
解答:解:A、氯化镁是强电解质,水溶液中完全电离生成镁离子和氯离子,电离方程式MgCl2═Mg2++2Cl﹣,故A正确;
B、Fe2(SO4)3是强电解质,水溶液中完全电离生成铁离子和硫酸根离子,电离方程式为:Fe2(SO4)3═2Fe3++3SO42﹣,故B正确;
C、NaClO是强电解质水溶液中完全电离生成钠离子和次氯酸根离子,NaClO═Na++ClO﹣,故C错误;
D、KAl(SO4)2属于强电解质,水溶液中完全电离,电离方程式为:KAl(SO4)2═K++Al3++2SO42﹣,故D正确;
故选C.
点评:本题考查了电离方程式书写方法,注意电离出离子的分析判断,题目较简单.
下列说法正确的是()
A.NaOH的摩尔质量是40g
B.1mol H2的质量与它的相对分子质量相等
C.1mol H2O的质量为18g/mol
D.氧气的摩尔质量在数值上等于它的相对分子质量
知识点:物质的量的计算
D
考点:摩尔质量;物质的量的相关计算.
专题:计算题.
分析:A、根据摩尔质量的单位g/mol进行判断;
B、质量的单位为g,而相对分子量单位省略不写;
C、根据质量的单位是g进行判断;
D、根据摩尔质量与相对分子量的数值关系进行分析.
解答:解:A、氢氧化钠的摩尔质量为40g/mol,质量的单位是g,故A错误;
B、1mol氢气的质量是2g,氢气的相对分子量为2,二者单位不同,所以不相等,故B错误;
C、质量单位是g,1mol水的质量是18g,故C错误;
D、摩尔质量以g/mol为单位时,摩尔质量在数值上等于它的相对分子质量,故D正确;
故选:D.
点评:本题考查了摩尔质量,注意摩尔质量的单位是g/mol,质量的单位是g,本题难度不大.
下列各组变化中,后者一定包括前者的是()
A.化学变化、物理变化 B.氧化还原反应、复分解反应
C.氧化还原反应、化合反应 D.中和反应、复分解反应
知识点:物质的分类
D
考点:物理变化与化学变化的区别与联系;氧化还原反应.
专题:物质的分类专题.
分析:根据物质变化的分类,若物质的成分没有发生变化,只是形态发生变化的为物理变化,有新化学物质生成的为化学变化,两者是并列的关系;氧化还原反应一定有电子的得失,复分解反应只是反应物相互交换成分,不存在电子的得失;化合反应一定有电子的得失,属于氧化还原反应,而氧化还原反应则包含更多的类型;中和反应属于复分解反应等知识点来解题.
解答:解:A.化学变化和物理变化是物质变化的两种基本形式,是并列的关系,故A错误;
B.氧化还原反应要有电子的得失,而复分解反应只是参与反应的物质相互交换成分,因此不存在包含关系,故B错误;
C.所有的化合反应都是氧化还原反应,而氧化还原反应不一定是化合反应,故C错误;
D.中和反应属于复分解反应,故D正确;
故选D.
点评:本题考查了物理变化和化学变化不同,氧化还原反应与复分解反应和化合反应的关系,中和反应与复分解反应的关系等知识点.
下列各项操作错误的是()
A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出
C.萃取、分液前需对分液漏斗检漏
D.为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下(或使塞上的凹槽对准漏斗上的小孔)
知识点:仪器和基本操作
A
考点:分液和萃取.
专题:化学实验基本操作.
分析:A.酒精和水是互溶的,不能做萃取剂;
B.分液操作时下层液体从下口放出,上层液体从上口倒出;
C.分液漏斗使用前先检查是否漏水;
D.打开塞子使漏斗内外压强相等.
解答:解:A.酒精和水是互溶的,不能做萃取剂来萃取溴水中的溴单质,可以用四氯化碳来萃取,故A错误;
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,避免两种液体相互污染,故B正确;
C.分液漏斗使用前要先检查是否漏水,故C正确;
D.打开塞子使漏斗内外压强相等,保证液体顺利流出,故D正确.
故选A.
点评:本题考查萃取和分夜,题目难度不大,掌握萃取剂的选择是解题的关键.
(双选)某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤;
正确的操作顺序是()
A.③②①⑤④ B.①②③⑤④ C.②③①⑤④ D.③⑤②①④
知识点:仪器和基本操作
AC
考点:粗盐提纯.
专题:实验题;化学实验基本操作.
分析:从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.
解答:解:首先要把粗盐溶于水形成溶液,然后镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,所以正确的顺序为③②①⑤④或②③①⑤④;
故选AC.
点评:除杂问题是化学实验中的一类重要问题,除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,把握好此原则需要我们有扎实的基础知识和缜密的思维.
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是()
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
知识点:物质的分离、除杂和提纯
C
考点:物质的分离、提纯的基本方法选择与应用.
专题:化学实验基本操作.
分析:分液法可以将互不相溶的两层液体分开;蒸馏法是控制沸点的不同来实现互溶的两种液体物质间的分离方法,萃取分液法指的是加入萃取剂后,溶质在萃取剂中的溶解度远远大于在以前的溶剂中的溶解度,并两种溶剂互不相溶,出现分层现象.
解答:解:①汽油不溶于水,所以汽油和氯化钠溶液是分层的,可以采用分液的方法分离;
②酒精和水是互溶的两种液体,可以采用蒸馏的方法来分离;
③向氯化钠和单质溴的水溶液中加入萃取剂四氯化碳后,溴单质会溶解在四氯化碳中,四氯化碳和水互不相溶而分层,然后分液即可实现二者的分离.
故选C.
点评:本题考查学生物质分离的方法,熟记教材知识是解题的关键所在,难度不大.
下列实验方案中可行的事()
A.用溶解、过滤的方法分离CaCl2和NaCl的固体混合物
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用酒精把碘水中的碘萃取出来
D.用澄清石灰水检验CO中是否含有CO2
知识点:仪器和基本操作
D
考点:化学实验方案的评价;物质的分离、提纯的基本方法选择与应用.
专题:化学实验基本操作.
分析:A.CaCl2和NaCl的固体均溶于水;
B.氯化钡与硫酸钠反应生成硫酸钡沉淀和NaCl;
C.酒精与水不分层;
D.二氧化碳与石灰水反应生成白色沉淀,CO不能.
解答:解:A.CaCl2和NaCl的固体均溶于水,则溶解后过滤不能分离,故A错误;
B.氯化钡与硫酸钠反应生成硫酸钡沉淀和NaCl,引入新杂质NaCl,应加氢氧化钡来除杂,故B错误;
C.酒精与水不分层,不能萃取,则利用苯或四氯化碳把碘水中的碘萃取出来,故C错误;
D.二氧化碳与石灰水反应生成白色沉淀,CO不能,则用澄清石灰水检验CO中是否含有CO2,故D正确;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及混合物分离、提纯、除杂及检验等知识点,把握物质的性质及性质的差异、混合物分离方法等为解答的关键,侧重实验基本技能的考查,注意实验的评价性分析,题目难度不大.
下列说法中不正确的是()
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.32g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
知识点:物质的量的计算
D
考点:阿伏加德罗常数;摩尔质量;气体摩尔体积.
专题:阿伏加德罗常数和阿伏加德罗定律.
分析:A、6.02×1023个磷酸分子为1mol,根据摩尔质量的概念分析;
B、物质的量相同的物质,质量比等于摩尔质量比;
C、计算氧气的物质的量,结合分子组成计算原理数目;
D、常温常压下气体的气体摩尔体积不等于22.4L/mol.
解答:解:A、摩尔质量是指1mol物质的质量,6.02×1023个磷酸分子为1mol,则磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等,故A正确;
B、6.02×1023个氮分子和6.02×1023个氢分子的物质的量都为1mol,质量分别为1mol×28g/mol=28g,1mol×2g/mol=2g,所以6.02×1023个氮分子和6.02×1023个氢分子的质量比等于
14:1,故B正确;
C、32g氧气的物质的量为1mol,1个氧气分子中含2个O原子,所以32g氧气所含的原子数目为2×6.02×1023,故C正确;
D、常温常压下气体的气体摩尔体积不等于22.4L/mol,不能确定常温常压下,0.5×6.02×1023个一氧化碳分子所占体积,故D错误.
故选D.
点评:本题考查阿伏加德罗常数知识,题目难度不大,注意物质的组成、结构、状态、性质及存在条件等.
下列反应中必须加入还原剂才能进行的是()
A.Cl2→Cl﹣ B.Zn→Zn2+ C.H2→H2O D.CuO→CuCl2
知识点:氧化还原反应
A
考点:氧化还原反应.
专题:氧化还原反应专题.
分析:变化中某元素的化合价降低,发生还原反应,则一般需要加入还原剂才能实现氧化还原反应.注意通过分解反应可以实现的,不一定需要加入还原剂.
解答:解:A、Cl2→Cl﹣氯元素化合价由0价降低为﹣1价,发生还原反应,需加入还原剂才能实现,故A正确;
B、Zn→Zn2+锌元素化合价由0价升高为+2价,发生氧化反应,需加入氧化剂才能实现,故B错误;
C、H2→H2O氢元素化合价由0价升高为+1价,发生氧化反应,需加入氧化剂才能实现,故C错误;
D、CuO→CuCl2铜元素化合价未发生变化,不是氧化还原反应,可通过CuO与盐酸反应实现,故D错误;
故选:A.
点评:本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,注意注意通过分解反应可以实现的,不一定需要加入还原剂或氧化剂.
将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是()
A.冷水 B.NaCl溶液 C.NaOH溶液 D.沸水
知识点:分散系
D
考点:胶体的重要性质.
专题:溶液和胶体专题.
分析:氢氧化铁胶体的制备方法是,向沸水中滴加饱和的氯化铁溶液,加热到呈红褐色,得到胶体,反应为FeCl3+3H2O Fe(OH)3(胶体)+3HCl.
Fe(OH)3(胶体)+3HCl.
解答:解:A.FeCl3在冷水中水解程度较小,不能生成胶体,故A错误;
B.NaCl溶液与FeCl3溶液不反应,故B错误;
C.氢氧化钠溶液会和FeCl3反应生成沉淀,不能生成胶体,故C错误;
D.沸水中氯化铁水解生成氢氧化铁胶体,故D正确.
故选D.
点评:本题考查了胶体的制备方法和条件,难度不大,平时注意知识的积累.
胶体区别于其他分散系的本质特征是()
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.胶体能产生丁达尔效应
C.胶体分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
知识点:分散系
C
考点:胶体的重要性质.
专题:溶液和胶体专题.
分析:胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同.
解答:解:胶体区别于其它分散系的本质特征是胶体粒子直径在1﹣100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm.
故选C.
点评:本题考查了胶体的本质特征,较简单,注意基础知识的积累.
从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是()
A.Na2S B.S C.SO2 D.H2SO4
知识点:氧化还原反应
A
考点:氧化还原反应;重要的氧化剂.
专题:氧化还原反应专题.
分析:元素化合价处于最高价态的物质可能具有氧化性,处于中间价态的物质既有氧化性又有还原性,而处于最低价态时,只具有还原性.
解答:解:A、硫化钠中硫元素处于最低价,该物质只有还原性,不能表现氧化性,故A正确;
B、单质硫中,硫元素的化合价处于中间价,既有氧化性又有还原性,故B错误;
C、二氧化硫中,硫元素的化合价处于中间价,既有氧化性又有还原性,故C错误;
D、硫酸中硫元素处于最高价,该物质中的硫元素只能表现氧化性,故D错误.
故选A.
点评:本题考查学生物质中元素的化合价和物质的性质间的关系,可以根据所学知识进行回答,难度不大.
下列反应中属于非氧化还原反应的是()
A.CaO+H2O═Ca(OH)2 B.2FeCl3+Cu═2FeCl2+CuCl2
C.Cl2+H2O═HCl+HClO D.2FeCl2+Cl2═2FeCl3
知识点:氧化还原反应
A
考点:氧化还原反应.
专题:氧化还原反应专题.
分析:有电子转移的化学反应是氧化还原反应,则没有电子转移的化学反应就是非氧化还原反应,其特点是没有化合价的升降.
解答:解:A.该反应中,反应前后各元素的化合价都没有发生变化,所以是非氧化还原反应,故A选;
B.该反应中,铜失电子,氯化铁得电子,所以有电子转移,为氧化还原反应,故B不选;
C.该反应中,氯气既得电子又失电子,所以有电子转移,为氧化还原反应,故C不选;
D.该反应中,氯气得电子,氯化亚铁失电子,所以有电子转移,为氧化还原反应,故D不选;
故选A.
点评:本题考查了氧化还原反应的判断,明确元素的化合价是解本题的关键,难度不大.
(双选)下列有关氧化还原反应的叙述正确的是()
A.肯定有一种元素被氧化,另一种元素被还原
B.在反应中不一定所有元素的化合价都发生变化
C.置换反应一定属于氧化还原反应
D.化合反应和复分解反应中不可能包含氧化还原反应
知识点:氧化还原反应
BC
考点:氧化还原反应.
专题:氧化还原反应专题.
分析:A、氧化还原反应中可能同种元素既被氧化又被还原.
B、氧化还原反应中一定存在元素的化合价变化,可能为同种元素,也可能为不同元素;
C、置换反应中一定存在化合价的变化,有化合价变化的是氧化还原反应;
D、有单质参加的化合反应属于氧化还原反应,复分解反应一定不是氧化还原反应;
解答:解:A、反应2H2S+SO2═3S↓+2H2O中只有硫元素的化合价变化,故A错误;
B、反应2H2S+SO2═3S↓+2H2O中,H、O元素的化合价不变,则反应中不一定所有元素的化合价都发生变化,故B正确;
C、置换反应中一定存在化合价的变化,一定是氧化还原反应,故C正确;
D、有单质生成的分解反应属于氧化还原反应,如氯酸钾分解,而复分解反应一定不属于氧化还原反应,故D错误.
故选:BC.
点评:考查氧化还原反应及常见的化学反应,学生熟悉利用元素的化合价来分析性质,注意四种基本反应类型与氧化还原反应的关系.
已知3.2g某气体中含有3.01×1022个分子,此气体的摩尔质量是()
A.32g/mol B.64 C.64g/mol D.4g
知识点:物质的量的计算
C
考点:摩尔质量.
专题:计算题;化学用语专题.
分析:先根据物质的量n=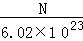 计算出3.2g该气体的物质的量,然后根据摩尔质量的表达式:M=
计算出3.2g该气体的物质的量,然后根据摩尔质量的表达式:M=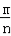 计算出该气体的摩尔质量.
计算出该气体的摩尔质量.
解答:解:3.01×1022个分子的物质的量为:n=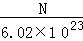 =
=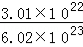 =0.05mol,
=0.05mol,
该气体的摩尔质量为:M= =
=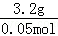 =64g/mol,
=64g/mol,
故选C.
点评:本题考查了摩尔质量的计算,题目难度不大,注意掌握摩尔质量的概念及计算方法,明确摩尔质量与物质的量、阿伏伽德罗常数之间的关系为解答本题的关键.
氢化钙可以作为生氢剂(其中CaH2中氢元素为﹣1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是()
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
知识点:氧化还原反应
B
考点:氧化还原反应.
专题:氧化还原反应专题.
分析:该反应中,CaH2中H的化合价为﹣1,H2O中H的化合价为+1,H2中H的化合价为0,根据元素化合价变化来分析解答.
解答:解:该反应中,CaH2中H的化合价为﹣1,H2O中H的化合价为+1,H2中H的化合价为0,所以氢化钙失电子作还原剂,水得电子作氧化剂,故选B.
点评:本题考查了氧化剂和还原剂的判断,明确元素化合价变化即可解答,结合氧化剂和还原剂概念来分析,难度不大.
(双选)用NA表示阿伏加德罗常数,下列叙述正确的是()
A.标准状况下,22.4 L H2O含有的分子数为1 NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
C.通常状况下,NA个CO2分子的质量是44g
D.2 mol NaOH溶于1 L水中配成溶液的浓度为2 mol•l﹣1
知识点:物质的量的计算
BC
考点:阿伏加德罗常数.
专题:阿伏加德罗常数和阿伏加德罗定律.
分析:A、标况下,水为液态;
B、求出碳酸钠的物质的量n= ,然后根据1mol碳酸钠中含2mol钠离子来计算;
,然后根据1mol碳酸钠中含2mol钠离子来计算;
C、求出二氧化碳的物质的量n=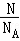 然后根据质量m=nM来计算;
然后根据质量m=nM来计算;
D、溶液的体积不等于溶剂的体积.
解答:解:A、标况下,水为液态,故A错误;
B、碳酸钠的物质的量n= =
=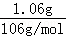 =0.01mol,而1mol碳酸钠中含2mol钠离子,故0.01mol碳酸钠中含0.02mol钠离子,故B正确;
=0.01mol,而1mol碳酸钠中含2mol钠离子,故0.01mol碳酸钠中含0.02mol钠离子,故B正确;
C、二氧化碳的物质的量n=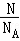 =1mol,质量m=nM=1mol×44g/mol=44g,故C正确;
=1mol,质量m=nM=1mol×44g/mol=44g,故C正确;
D、溶液的体积不等于溶剂的体积,将氢氧化钠溶于1L水中后,所得溶液的体积大于1L,故配成溶液的浓度小于2mol/L,故D错误.
故选BC.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.
标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③5.6g CH4 ④0.5mol HCl,下列关系正确的是()
A.体积大小:④>③>①>② B.原子数目:③>①>④>②
C.密度大小:④>②>③>① D.质量大小:④>③>②>①
知识点:物质的量的计算
B
考点:阿伏加德罗常数.
专题:阿伏加德罗常数和阿伏加德罗定律.
分析:A、相同条件下,体积之比等于物质的量之比;
B、计算各物质中原子的物质的量,微原子数目之比等于物质的量之比;
C、同温同压下,密度之比等于相对分子质量之比;
D、计算各物质的物质的量,再根据m=nM计算质量,据此进行判断.
解答:解:标准状况下,①6.72L NH3的物质的量为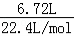 =0.3mol;
=0.3mol;
②1.204×1023个 H2S的物质的量为 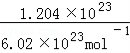 =0.2mol;
=0.2mol;
③5.6g CH4 的物质的量为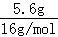 =0.4mol;
=0.4mol;
④0.5mol HCl,
A、由上述计算可知物质的量④>③>①>②,相同条件下,体积之比等于物质的量之比,所以体积大小④>③>①>②,故A正确;
B、①标准状况6.72L NH3中原子的物质的量为0.3mol×4=1.2mol,
②1.204×1023个 H2S含有的原子的物质的量为0.2mol×3=0.6mol;
③5.6g CH4含有的原子的物质的量为0.4mol×5=2mol;
④0.5mol HCl含有的原子的物质的量为0.5mol×2=1mol,原子数目之比等于物质的量之比,
所以原子数目③>①>④>②,故B正确;
C、同温同压下,密度之比等于相对分子质量之比,①NH3相对分子质量为17;②H2S 相对分子质量为34; ③CH4相对分子质量为16④HCl相对分子质量为36.5,故密度大小④>②>①>③,故C错误;
D、①NH3质量为17g/mol×0.3mol=5.1g;
②H2S 质量为34g/mol×0.2mol=6.8g;
③CH4量为16g/mol×0.4mol=6.4g;
④HCl质量为36.5g/mol×0.5mol=18.25g,
故质量大小④>②>③>①,个D错误.
故选:B.
点评:考查常用化学计量数有关计算,难度不大,计算量较多细心计算,注意化学计量数之间的公式运用.
(双选)下列反应的离子方程式正确的是()
A.氢氧化钡中加入稀硫酸:Ba2++OH﹣+SO42﹣+H+=BaSO4↓+H2O
B.氧化铜溶于稀硫酸:2H++CuO=Cu2++H2O
C.碳酸钙溶于盐酸:CO32﹣+2H+=CO2↑+H2O
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH﹣+CO2=CaCO3↓+H2O
知识点:离子方程式
BD
考点:离子方程式的书写.
专题:离子反应专题.
分析:A.氢离子、氢氧根离子的系数错误,不满足硫酸、氢氧化钡的化学式组成;
B.氧化铜与稀硫酸反应生成可溶性的硫酸铜和水;
C.碳酸钙为难溶物,离子方程式中碳酸钙不能拆开,需要保留化学式;
D.二氧化碳少量,反应生成碳酸钙沉淀和水.
解答:解:A.氢氧化钡与硫酸反应生成硫酸钡沉淀和水,正确的离子方程式水为:Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O,故A错误;
B.氧化铜溶于稀硫酸,反应的离子方程为:2H++CuO=Cu2++H2O,故B正确;
C.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D.澄清石灰水中通入少量二氧化碳,反应生成碳酸钙沉淀和水,反应的离子方程式为:Ca2++2OH﹣+CO2=CaCO3↓+H2O,故D正确;
故选BD.
点评:本题考查离子方程式的书写,为高考常见题型和高频考点,题目难度中等,试题侧重于学生的分析能力的考查,注意把握离子的性质以及反应的特点,熟练掌握离子方程式的书写原则.
(双选)在碱性溶液中能大量共存且溶液为无色透明的离子组是()
A.K+、MnO4﹣、Na+、Cl﹣ B.K+、Na+、NO3﹣、CO32﹣
C.Ca2+、HCO3﹣、C1﹣、K+ D.Ba2+、Na+、Cl﹣、NO3﹣
知识点:离子共存
BD
考点:离子共存问题.
专题:离子反应专题.
分析:碱性溶液中存在大量的OH﹣,离子之间不能结合生成气体、沉淀、水等,则离子能大量共存,并注意离子的颜色来解答.
解答:解:A.MnO4﹣有颜色,不符合题目要求,故A错误;
B.溶液无色,碱性条件下不发生任何反应,可大量共存,故B正确;
C.碱性条件下Ca2+、HCO3﹣反应生成沉淀和水,不能大量共存,故C错误;
D.溶液无色,碱性条件下不发生任何反应,可大量共存,故D正确.
故选BD.
点评:本题考查离子的共存问题,为高频考点,侧重于学生的分析能力的考查,熟悉离子之间的反应及常见离子在水中的颜色即可解答,难度不大.
对于某些离子的检验及结论正确的是()
A.加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32﹣
B.加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42﹣
C.加盐酸无现象,再加氯化钡溶液有白色沉淀产生,原溶液中一定有SO42﹣
D.加入AgNO3溶液后有白色沉淀,原溶液中一定有Cl﹣
知识点:物质的检验和鉴别
C
考点:常见离子的检验方法.
专题:离子反应专题.
分析:A.该气体可能为二氧化碳或二氧化硫,原溶液中可能存在CO32﹣、HCO32﹣、SO32﹣、HSO3﹣;
B.加入氯化钡产生白色沉淀,该沉淀可能为氯化银,溶液中不一定存在硫酸根离子;
C.加入足量稀盐酸无现象,如再加入氯化钡溶液后有白色沉淀产生,说明含有SO42﹣;
D.应该加入硝酸酸化,不能使用盐酸,否则无法排除溶液中可能存在的碳酸根离子、亚硫酸根离子等.
解答:解:A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该气体可能为二氧化碳或二氧化硫,原溶液中可能有CO32﹣、HCO32﹣、SO32﹣、HSO3﹣,故A错误;
B.加入氯化钡溶液有白色沉淀产生,该白色沉淀可能为氯化银,再加盐酸AgCl不溶解,原溶液中可能存在银离子,不一定有SO42﹣,故B错误;
C.加入足量稀盐酸无现象,可排除Ag+的影响,如再加入氯化钡溶液后有白色沉淀产生,说明含有SO42﹣,故C正确;
D.加入硝酸银溶液产生白色沉淀,原溶液中可能存在碳酸根离子、亚硫酸根离子等,再滴加盐酸后沉淀转化成氯化银沉淀,白色沉淀不消失,所以无法判断原溶液中是否含有Cl﹣,故D错误;
故选C.
点评:本题考查离子的性质与检验方法,侧重于检验方法的评价,注意把握常见离子的性质以及检验方法,检验时要排除其它离子的干扰,确保检验方案的严密性.