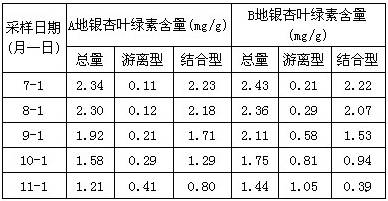
前不久,北大校长的《化学之歌》风靡网络,指出下面四句歌词涉及的物质中,大多是通过聚合反应制得的是
A.“你我要温暖漂亮,化学提供,衣装婀娜”
B.“你我要吃足喝好,化学提供,营养多多”
C.“你我要飞天探地,化学提供![]() ,动力几何”
,动力几何”
D.“即便你我的身心健康,也是化学密码解锁”
知识点:有机合成及高分子化合物
A
略
化学概念在逻辑上存在如下几种关系:
有关概念的说法正确的是
A.纯净物与混合物属于包含关系 B.单质与化合物属于交叉关系
C.化合物与碱性氧化物属于包含关系 D.氧化还原反应与分解反应属于并列关系
知识点:氧化还原反应
C
略
如果把2Fe![]() Cl3 + Cu → 2FeCl2
+ CuCl2设计成原电池,则在正极上生成的离子是
Cl3 + Cu → 2FeCl2
+ CuCl2设计成原电池,则在正极上生成的离子是
A.Cl- B.Fe2+ C.Cu2+ D.Fe3+
知识点:原电池
B
略
实验中需0.1 mol/L的Na2CO3溶液950 mL,用容量瓶配制时应称取Na2CO3·H2O粉末的质量为
A.10.07克 B.10.60克 C.11.78克 D.12.40克
知识点:溶液浓度的计算
D
略
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7 酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。与此测定原理有关的乙醇的性质是
A.乙醇有可燃性 B.乙醇有还原性
C.乙醇密度比水小 D.乙醇有氧化性
知识点:乙醇和醇类
B
略
将硝酸铵晶体溶于水中,温度与时间变化曲线(其中a代表扩散过程中温度![]() 变化情况,b代表水合过程中温度变化情况)中符合实际的是
变化情况,b代表水合过程中温度变化情况)中符合实际的是
知识点:化学反应与能量的变化
C
略
有一种测定阿伏加德罗常数的方法需测定一定量NaCl晶体的体积,具体步骤为:准确称出一定量NaCl晶体置于定容仪器a中,用滴定管向仪器a中滴加某液体b 至a仪器的刻度线,即可测出NaCl晶体的体积。上述操作中的a、b分别指
A.量筒、水 B.容量瓶、四氯化碳
C.量筒、苯 D.容量瓶、水
知识点:化学中常用计量
B
略
居里夫人为了纪念自己的祖国,把她发现的元素命名为钋、镭,其中钋(84Po)元素的一种同位素的中子数是质子数的1.49倍。该原子的质量数为
A.84 B.125 C.209.16 D.209
知识点:元素周期律与元素周期表
D
略
漂粉精久置于空气中会变质,在变质过程中不会涉及的性质是
A.HClO的漂白性 B.HClO的不稳定性
C.HClO的弱酸性 D.H2CO3的酸性
知识点:卤素
A
略
常温下,把2.7g铝投入到一定量氢氧化钠溶液中,充分反应后,下列表示正确的是(NA为阿佛加德罗常数)
电子转移
反应的Al
溶液中的AlO2-
生成的H2
A
0.2NA
0.1NA
B
0.3NA
0.3NA
C
2.7g
3.36L
D
0.1NA
2.7g
知识点:镁铝及其化合物
A
略
在2010年温哥华冬季奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。如图是检测出兴奋剂X的结构,关于兴奋剂X的说法正确的是
A.1 mol X 与足量的NaOH 溶液在一定条件下反应,最多消耗4 mol NaOH
B.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.X 遇到FeCl3 溶液时显紫色,而且能使溴的四氯化碳溶液褪色
知识点:苯酚和酚类
D
略
现有一瓶甲、乙的混合物,已知甲、乙属同系物,甲、乙某些性质如下:
物质
分子式
熔点(℃)
沸点(℃)
密度(g/cm3)
水溶性
甲
C3H6O2
-98
57.5
0.9![]() 3
3
可溶
乙
C4H8O2
-84
77
0.90
可溶
根据物理性质,将混合物中甲、乙分离的最佳方法是
A.蒸馏 B.萃取 C.加热升华 D.分液
知识点:物质的分离、除杂和提纯
A
略
已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
t℃
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
有关叙述错误的是
A.该反应的化学方程式是:CO(g)+H2O(g)
![]() CO
CO![]() 2(g)+H2(g)
2(g)+H2(g)
B.该反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830 ℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态
D.若平衡浓度关系符合![]() =
=![]() ,可判断此时温度是1000 ℃
,可判断此时温度是1000 ℃
知识点:化学平衡状态及移动
C
略
将固体MnC2O4·2H2O放在坩埚里加热,固体质量随温度变化的数据如下表:
温度(℃)
25
50
75
100
214
280
固体质量(g)
17.9
17.9
16.0
14.3
14.3
7.10
下列说法错误的是
A.25~50 ℃,MnC2O4·2H2O未发生变化
B.75 ℃时,MnC2O4·2H2O部分失去结晶水
C.100℃时,坩埚内固体均为MnC2O4
D.280℃时,坩埚内固体为混合物
知识点:物质的分离、除杂和提纯
D
略
将等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水,取该混合液滴入到含有品红和Ba(NO3)2的溶液中,则发生的实验现象是
A.红色溶液很快褪色 B.红色溶液不褪色
C.溶液中有沉淀生成 D.溶液中有气泡产生
知识点:氧族元素
BC
略
X、Y、Z是原子序数依次增大且属于不同周期的三种常见短周期元素,三种元素相互之间可以形成1︰1型的化合物M、N、R,常温下M、N为固体,R为液体。M、N遇到水都能产生气体,而且产生的气体相互可以化合,下列说法正确的是
A.R中有极性共价键和非极性共价键 B.Z是地壳中含量最多的元素
C.三种化合物都是共价化合物 D.M、N投入水中所得溶液中溶质相同
知识点:元素周期律与元素周期表
AD
略
把一定量金属钠投入Ca(HCO3)2溶液中,有多个反应发生,下列有关的离子方程式正确的是
A.2Na + 2H+ = 2Na+ + H2↑
B.Ca2+ + HCO3—+ OH- =CaCO3↓ + H2O
C.Ca2+ + 3HCO3—+ 3OH-=CaCO3↓ + 2CO32—+ 3H2O
D.Ca2+
+ 2HCO3—![]() CaCO3↓
+ CO2↑ + H2O
CaCO3↓
+ CO2↑ + H2O
知识点:离子方程式
BD
略
在室温时,向体积为V1、浓度为c1、pH=a的醋酸溶液中加入体积为V2、浓度为c2、pH=b的氢氧化钠溶液,充分反应。下列关于反应后混合液的叙述一定正确的是
A.若pH=7,且V1=V2,则c1>c2
B.若pH<7,则c(CH3COO-)>c(Na+)>c (H+)>c (OH-)
C.若cl=c2,且V1=V2,则a+b=14
D.若pH>7,且V1=V2,则cl<c2
知识点:盐类水解
A
略
将0.3mol KMnO4在一定温度下加热后生成x
molO2;将剩余固体与过量浓盐酸混合加热又生![]() 成y mol Cl2,此时锰元素全部以Mn2+形式存在。若x+y=a,则a的值可能为
成y mol Cl2,此时锰元素全部以Mn2+形式存在。若x+y=a,则a的值可能为
A.0.85 B.0.75 C.0.65 D.0.60
知识点:物质的量的计算
CD
略
用于金属焊接的某种焊条,其药皮由大理石、硅酸盐、硅铁等配制而成。根据题意回答:
1.Al原子的核外电子排布式为_____________________;Al与NaOH溶液反应的离子方程式为_______________![]() _________________________________。
_________________________________。
2.Si原子核外有 种不同能量的电子。硅铁属于合金,它的熔点比纯铁
(填“高”、“低”或“不一定”)。
3.Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________,最不稳定的是 。
4.焊接过程中,药皮在高温下产生了熔渣和一种气体,该气体是_________,该气体在固态时属于 晶体。
知识点:晶体结构与性质

略
(本题共8分)
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。根据题意回答:
1.31g白磷与足量的氧气完全燃烧生成P2O5固体,释放出745.5 kJ的热量,请写出白磷燃烧的热化学反应方程式:
![]() ;
;
2.完成并配平白磷和氯酸溶液反应的化学方程式:
P4 + HClO3 + → HCl + H3PO4
3.白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是 ,若有1.1 mol P4反应,则有 mol电子转移。
4.磷的一种化合物叫亚磷酸(H3PO3)。已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO![]() 3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是
.
3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是
.
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
知识点:氧化还原反应

略
(本题共8分)
NO和CO都是有毒的气体,利用催化技术能够将它们转变成无毒的CO2和N2。一定量的NO和CO进行如下反应:2NO+2CO![]() 2CO2+N2,其部分化学平衡常数如下表:
2CO2+N2,其部分化学平衡常数如下表:
T(℃)
0
50
100
K
0.5
1.05
2.56
l 根据题意回答(均不考虑温度变化对催化剂催化效率的影响):
1.若把化学方程式写为NO+CO![]() CO2+1/2N2,则100℃时,K的值=
。
CO2+1/2N2,则100℃时,K的值=
。
2.上述反应达到化学平衡后,下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
3.若上述反应在容积不变的密闭容器中进行,该可逆反应达到平衡的标志是____
![]() A.气体的密度不再变化
A.气体的密度不再变化
B.单位时间内消耗的CO与生成的CO2的物质的量之比为1︰1
C.气体的压强不再变化
D.各气体的浓度相等
4.某温度下,将0.02 mol的NO和0.02 mol的CO的混合气体充入一装有催化剂的容器中,充分反应后,测得混合气体中CO的体积分数为0.125,则CO的转化率为 。
知识点:化学平衡状态及移动
(共8分)
1、1.60(2分)2、BD(2分)3、C(2分)4、80%(2分)
略